SÄUREN UND BASEN
WAS SIND SÄUREN?
Zwischen den Reaktionspartnern stellt sich ein chemisches Gleichgewicht ein.
Säuren zerfallen in Wasser in positiv geladene Wasserstoffionen und negativ geladene Säurerestionen.
Säuren im Alltag:
Säuren sind in vielen Stoffen des Alltags vorhanden. Entkalker enthalten eine Säure, die Kalkverschmutzungen auflöst. Säuren benötigt man auch zum Haltbarmachen von Lebensmitteln. Als Lebensmittel-Zusatzstoffe befinden sie sich in vielen Getränken (Weinsäure, Kohlensäure). Sie kommen in der Natur auch zahlreich vor (Essigsäure, Milchsäure, Buttersäure, Ameisensäure, Zitronensäure,…).
Säuren wirken sauer und färben Universalindikatorlösung rot.
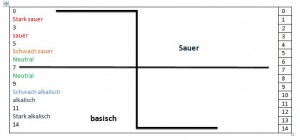
pH-Werte:
Säuren sind unterschiedlich stark. Die Stärke jeder Säure hängt vom pH- Wert ab, denn je kleiner der pH- Wert ist desto stärker ist die Säure. Die stärksten Säuren sind die Salpetersäuren, die Salzsäuren und die Schwefelsäuren. Die Stärke der sogenannten „Supersäuren“ lässt sich mit dem pH- Wert allerdings nicht mehr ausdrücken.
Der pH ist ein Maß für die Zahl der Protonen bzw. H3O+ Ionen in einer sauren Lösung.
UNTERSCHIED SÄURE-SAURE LÖSUNG
Als Säure wird z.B. bei der Zitronensäure der feste Reinstoff bezeichnet, während bei der sauren Lösung, die auch wässrige Lösung genannt wird, dieser Stoff in Wasser gelöst ist. Es gibt auch reine Säuren, die bei Raumtemperatur flüssig sind (Bsp : H2SO4, HNO3, CH3COOH) und bei manchen sauren Lösungen ist der darin gelöste Stoff sogar gasförmig (Bsp HCl).
Grafik von -Tamara Beranek, Linda Kálló, Marinela Stanusic, 3HIA, 2012
EIGENSCHAFTEN VON SÄUREN
unterschiedliche Ausprägung der Eigenschaften (starke und schwache Säuren)
- saurer Geschmack
- Rotfärbung von Lackmus und Farbveränderung anderer Indikatoren
- ätzend/reaktiv (u.a. auch Stoffe, die von Basen nicht angegriffen werden)
- Zersetzung von Kalkstein, unedle Metalle, Haut, Augen, Kleidung, …
- elektrische Leitfähigkeit in wässriger Lösung
- Neutralisation mit Basen
Die Verdünnung von Säuren mit Wasser ist eine exotherme Reaktion! „Zuerst das Wasser, dann die Säure, sonst geschieht das Ungeheure.“
WICHTIGE SÄUREN
Wichtige Säuren sind:
- Schwefelsäure: H2SO4 (industrielle Verwendung, Saurer Regen)
- Salzsäure: HCl (industrielle Verwendung)
- Kieselsäure: H4SiO4
- Phosphorsäure: H3PO4 (Lebensmittelindustrie, unter anderem Cola, DNA)
- Kohlensäure: H2CO3 (Lebensmittelindustrie, Technik, Atmosphäre)
- Essigsäure: CH3COOH (Salatbereitung in der Küche, Lebensmittelindustrie)
- Benzoesäure (Konservierungsmittel)
- Flusssäure: HF (Computerchipherstellung)
- Salpetersäure: HNO3 (industrielle Verwendung)
Auch Salze mehrprotoniger Säuren können als Säuren wirken („saure Salze“), beispielsweise
- Hydrogensulfate
- Hydrogenphosphate
Wichtige Säuren II?
HCl
HCl ist die Abkürzung für Chlorwasserstoff.
Was ist HCl?
HCl ist ein farbloses, stechend riechendes Gas, das sich sehr leicht in Wasser löst und nicht verbrennen kann. Es ist in gut wasserlöslich, bei Zimmertemperatur ca. 20°C lösen sich 442 Liter Gas in einem Liter Wasser. Diese Lösung nennt man Salzsäure. Chlorwasserstoff ist im trockenen Zustand und sogar bei hohen Temperaturen stabil. Unter Druck leitet wasserfreier Chlorwasserstoff elektrischen Strom ähnlich gut wie die Salzsäure.
Wie wird HCl hergestellt?
Chlorwasserstoff wird im Labor aus konzentrierter Schwefelsäure und Natriumchlorid hergestellt.
NaCl + H2SO4 à HCl + NaHSO4
Wofür wird es genutzt?
Chlorwasserstoff dient in der chemischen Industrie, zur Herstellung von Salzsäure und Chloriden. Zum Beispiel zur Zündung eines Gemisches aus Wasserstoff und Chlor durch Belichtung. Aber seit neustem wird mehr verflüssigter, wasserfreier Chlorwasserstoff verwendet anstatt Salzsäure, da er Rohrleitungen nicht angreift.
Chlorwasserstoff ist Bestandteil des Magensaftes allesfressender Tiere und bewirkt auch im menschlichen Magen die Denaturierung der Nahrung.
Was muss ich für meine Sicherheit darüber wissen?
Chlorwasserstoff ist ätzend und in hohen Mengen giftig. Vergiftungen sind aber sehr selten. Beim Einatmen können Reizungen der Schleimhäute und der Atemwege auftreten. Sollte man mit der Säure in Kontakt kommen kann man es mit Wasser abwaschen.
Kohlensäure
(Kohlenstoffsäure, Dihdrogencarbonat, Hydroxameisensäure, Hydroxymethamsäure, H2CO3)
„Echte“ Kohlensäure, tritt fast nicht in Reinform auf, denn zum einen wird bei der Reaktion mit Wasser nur ein geringer Teil des CO2 umgewandelt, zum anderen zerfällt die aufgebaute äußerst instabile Kohlensäure (H2CO3), schnell wieder in Bicarbonat-Ionen (HCO3-) und Protonen (H+). Kohlensäure kommt im Wasser gelöst vor.
Kohlensäure Ist das Reaktionsprodukt des Gases Kohlendioxid mit Wasser. CO2 ist in Wasser löslich und reagiert zum Teil zu Kohlensäure:
CO2 + H2O > H2CO3 (=Summenformel)
Geschichte:
Wurde zunächst aufgrund des säuerlichen Geschmackes in Mineralwasser bekannt. 1597 berichtete Andreas Libavius über die Kohlensäure. Genauere Kenntnisse wurden von Johan Baptista van Helmont bezüglich der Gärung und der Entwicklung von Mineralsäuren auf karbonhaltiges Gestein übermittelt.
Verwendungen:
- Wird für Produktionsprozesse weltweit eingesetzt, dem Endverbraucher ist jedoch am ehesten das Getränk bekannt. Im 19. Jahrhundert begann man, Mineralwasser Kohlenstoffdioxid beizumischen. (um es haltbar zu machen)
- Kohlenstoffdioxid ist unter anderen wichtig bei der sterilen Verpackungstechnik.
- Wird bei der Feuerwehr und in automatischen Löschanlagen in der Industrie als Löschmittel verwendet.
Erklärung:
Ausströmende Kohlensäure nimmt der Umgebung den Sauerstoff und das bringt das Feuer zum Erlöschen.
Vorteil:
Weder ein Wasserschaden noch ein Schaden durch Löschschaum.
Kohlensäure für die Atmung:
Die Umgebungsluft enthält:
- 78% Stickstoff
- 21% Sauerstoff
- Verschiedene Edelgase
- Wasserdampf
- 0,04% CO2
Unsere Ausatemluft enthält:
- 78% Stickstoff
- 17% Sauerstoff
- 4% Kohlendioxid
(CO2 = ‚Schalter‘ bei der Atemregulation)
WAS SIND BASEN?
Basen leiten den elektrischen Strom da sie Ionen (elektrisch geladene Teilchen) enthalten; Auch beim Lösen von Basen (z.B. NaOH) gilt: Erst das Wasser, dann die Lauge, weil sonst spritzt es dir ins Auge!
Das Lösen einer Base ist eine stark exotherme Reaktion! Nie eine Lauge in einem Joghurtbecher lösen; der könnte schmelzen!
WICHTIGE BASEN
NaOH
Natriumhydroxid (Ätznatron)
- Molmasse 39,997 g/mol
- Dichte 2,13 g/cm3
- Schmelzpunkt +323 °C
- Siedepunkt +1388 °C
- Wasserlöslichkeit
100g H2O lösen bei 25 °C 100 g
Eigenschaften
Bei Berührung mit der Haut wird diese verätzt, da das Natriumhydroxid mit derHautfeuchtigkeit zu Natronlauge reagiert. NaOH löst sich unter starker Wärmeentwicklung sehr leicht in Wasser, wobei sich Natronlauge bildet. An der Luft wandelt es sich mit Kohlenstoffdioxid zu Natriumcarbonat um. Es sollte gut verschlossen aufbewahrt werden, da es aus der Luft Wasserdampf anzieht (hygroskopische Wirkung). Natriumhydroxid löst sich auch gerne in Ethanol oder Glycerin.
Früher wurde Natriumhydroxid nach dem Kalk-Soda-Verfahren aus Natriumcarbonat und Calciumhydroxid hergestellt:
Heute gewinnt man es durch die Chlor-Alkali-Elektrolyse.
Die Ausgangsstoffe dabei sind Natriumchlorid (Kochsalz) und Wasser, als Produkte fallen Natronlauge (wässrige Lösung von Natriumhydroxid), Wasserstoff und Chlor an.
Verwendung
In Abflussreinigern ist oft Natriumhydroxid in fester Form enthalten. In Tauchgeräten oder in Narkosegeräten bindet das Natriumhydroxid (zusammen mit Calciumhydroxid)
den ausgeatmeten Kohlenstoffdioxidanteil. Dieser „Atem kalk“ findet auch in der Raumfahrt Anwendung. Beim Auflösen von Natriumhydroxid in Wasser erhält man Natronlauge. Die weiteren Verwendungen findet man daher dort.
NEUTRALISATION
Säure + Base -> Wasser + Salz
Salze:
Bildung: Metall + Nicht Metall reagieren miteinander,
Elektronenaufnahme (ein Stoff nimmt Elektronen auf) und -abgabe (Metall gibt Elektronen ab), das beding die Ionenbindung.Salze bilden eine regelmäßige Kristallgitterstruktur.
Eigenschaften – Salzkristalle sind spröde, sie haben sehr hohe Schmelz- und Siedepunkte
Salze sind Stoffe, die in wässriger Lösung in positiv geladene Metallionen (Kationen) und negativ geladene Säurerest-Ionen (Anionen) dissoziieren (zerfallen).
Auch die Neutralisation ist eine exotherme Reaktion; Immer nur verdünnte Basen und Säuren neutralisieren.
ENTSORGEN VON SÄUREN UND BASEN
Säuren und Basen müssen vor der Entsorgung im Abfluss neutralisiert werden. Säuren und Basen vorher verdünnen!
Nähere Informationen zum Entsorgen von Chemikalien findet ihr unter http://www.seilnacht.com/Chemie/entsorg.htm
- KOH Flocken
KOH Flocken
- geschmolzener Joghurtbecher
geschmolzener Joghurtbecher
- Zitrone
Zitrone
- by-Tamara Beranek, Linda Kálló, Marinela Stanusic
by-Tamara Beranek, Linda Kálló, Marinela Stanusic
MERKE beim Arbeiten und Experimentieren mit Säuren und Laugen IMMER Schutzbrille tragen und Schutzhandschuhe anziehen!!!!
Bericht erstellt von Dominik Laggner und Pia Braun, Melanie Wolf und Kathrin Marik, Anna Baier und Lisa Seemann 3HIA, Alexandra, Jennifer Gottlieb, Nino Trello und Julia Dutzi, Diana Maliqi, Sophie Klügel, Katharina Schlegl,1HMB, Teodora Nedeljkovic , 2FKA, 2012
Bilder: Silke Geroldinger
Quellen: http://de.wikipedia.org/wiki/S%C3%A4uren
http://www.seilnacht.com/Lexikon/Salze.htm
Säure und Basen Quiz
Wenn Du den Text über Säuren und Basen aufmerksam liest, kannst Du sicher folgende Fragen beantworten!